8.2. Пространственное строение молекул
В молекуле водорода химическая связь двух атомов осуществляется, как мы видели, за счет влияния электронных облаков между атомами. В невозбужденных атомах эти электроны находятся в s-состояниях, и их волновые функции сферически симметричны. Форма перекрывания этих облаков показана на рис. 8.4-1.

Рис. 8.4. Форма перекрывания электронных оболочек: 1 — оба электрона находятся в s-состоянии;
2 — один из электронов находится в р-состоянии
Но часто валентные электроны находятся в р-состоянии с угловым моментом, равным единице. В этом состоянии волновая функция, соответствующая нулевой проекции момента на какую-либо ось, пропорциональна косинусу угла q между этой осью и радиус-вектором. Следовательно, электронное облако имеет плотность, пропорциональную ![]() . Если изобразить такое облако на рисунке, то оно будет иметь форму восьмерки (точнее, тела, образованного вращением восьмерки вокруг продольной оси). Если такой р-электрон «спаривается» с s-электроном другого атома, то последний стремится «пристроиться» таким образом, чтобы перекрытие волновых функций было максимальным. Очевидно, что такая связь осуществляется в направлении вытянутости облака р-электрона (рис. 8.4-2).
. Если изобразить такое облако на рисунке, то оно будет иметь форму восьмерки (точнее, тела, образованного вращением восьмерки вокруг продольной оси). Если такой р-электрон «спаривается» с s-электроном другого атома, то последний стремится «пристроиться» таким образом, чтобы перекрытие волновых функций было максимальным. Очевидно, что такая связь осуществляется в направлении вытянутости облака р-электрона (рис. 8.4-2).
Электронное облако в состоянии m = 0 «обволакивает» ось z, в двух других состояниях с проекциями ![]() такие же облака вытянуты по осям x и y. Это помогает уяснить пространственное строение молекул различных веществ. Ниже мы приводим некоторые характерные примеры.
такие же облака вытянуты по осям x и y. Это помогает уяснить пространственное строение молекул различных веществ. Ниже мы приводим некоторые характерные примеры.
Вода Н20. Атом кислорода имеет две заполненные оболочки: 1s и 2s, на которых размещаются четыре электрона. Оставшиеся четыре валентных электрона находятся на оболочке 2р. Их электронные облака отталкиваются и стремятся расположиться подальше друг от друга: три облака вытягиваются по осям ![]() и четвертому деваться некуда. Скажем, оно располагается по оси z, причем электрон имеет противоположный спин по сравнению с другим электроном, облако которого также расположено вдоль этой оси. Образуются спаренные электроны, не участвующие в химической связи. Для химической связи остаются свободными два электрона — облака по осям x и y. Атомы водорода, подсоединяясь, как было сказано, образуют молекулу треугольной формы (рис. 8.5), причем угол
и четвертому деваться некуда. Скажем, оно располагается по оси z, причем электрон имеет противоположный спин по сравнению с другим электроном, облако которого также расположено вдоль этой оси. Образуются спаренные электроны, не участвующие в химической связи. Для химической связи остаются свободными два электрона — облака по осям x и y. Атомы водорода, подсоединяясь, как было сказано, образуют молекулу треугольной формы (рис. 8.5), причем угол ![]() между направлениями на атомы водорода должен быть равен 90°.
между направлениями на атомы водорода должен быть равен 90°.
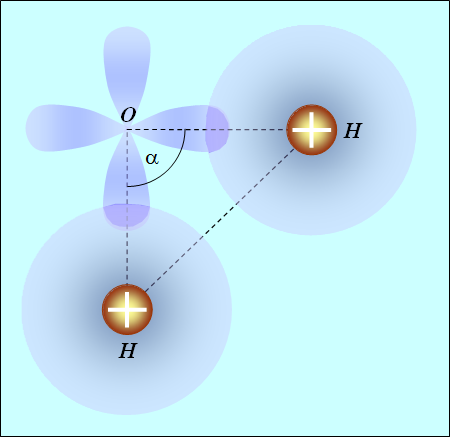
Рис. 8.5. Расположение атомов в молекуле воды
Но частично «оголенные» протоны также отталкиваются, и этот угол несколько возрастает: его экспериментальное значение ![]() . Это увеличение тем меньше, чем больше размер атома. Так, в аналогичном соединении
. Это увеличение тем меньше, чем больше размер атома. Так, в аналогичном соединении ![]() атом серы больше атома кислорода, отталкивание протонов слабее и угол уменьшается до
атом серы больше атома кислорода, отталкивание протонов слабее и угол уменьшается до ![]() . Еще больше атом селена, и в молекуле
. Еще больше атом селена, и в молекуле ![]() атомы водорода расположены под углом
атомы водорода расположены под углом ![]() .
.
Аммиак NH3. Атом азота имеет конфигурацию ![]() . Как и в кислороде, четыре электрона, находящиеся в 1s и в 2s состояниях, спарены и не участвуют в химической связи. Остаются три p-электрона, и все три связи расположены по осям
. Как и в кислороде, четыре электрона, находящиеся в 1s и в 2s состояниях, спарены и не участвуют в химической связи. Остаются три p-электрона, и все три связи расположены по осям ![]() . При подсоединении трех атомов водорода образуется правильная треугольная пирамида с атомом азота в вершине (см. рис. 8.6).
. При подсоединении трех атомов водорода образуется правильная треугольная пирамида с атомом азота в вершине (см. рис. 8.6).
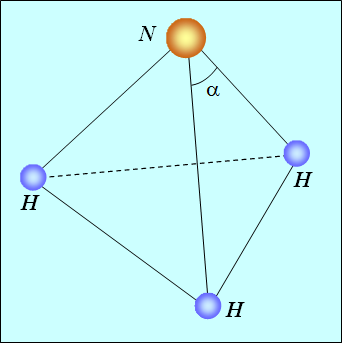
Рис. 8.6. Расположение атомов в молекуле аммиака
Из-за отталкивания протонов углы ![]() при вершине чуть больше
при вершине чуть больше ![]() . У похожего соединения, фосфина
. У похожего соединения, фосфина ![]() , угол ближе к прямому, а у
, угол ближе к прямому, а у ![]()
![]() . Из объемности молекулы аммиака следует существование двух вырожденных состояний, отличающихся положением атома азота по ту или иную сторону от основания пирамиды. Однако вырождение снимается вследствие квантовомеханического туннелирования, что ведет к расщеплению вырожденных уровней. Переходы между ними приводят к излучению, которое сделало возможным создание аммиачного мазера.
. Из объемности молекулы аммиака следует существование двух вырожденных состояний, отличающихся положением атома азота по ту или иную сторону от основания пирамиды. Однако вырождение снимается вследствие квантовомеханического туннелирования, что ведет к расщеплению вырожденных уровней. Переходы между ними приводят к излучению, которое сделало возможным создание аммиачного мазера.
Перекись водорода ![]() . В случае, когда спариваются два p-электрона, максимальное перекрытие получается, если их «восьмерки» ориентированы вдоль одной оси. Таким образом, соединяются два атома кислорода в молекуле перекиси водорода (рис. 8.7).
. В случае, когда спариваются два p-электрона, максимальное перекрытие получается, если их «восьмерки» ориентированы вдоль одной оси. Таким образом, соединяются два атома кислорода в молекуле перекиси водорода (рис. 8.7).

Рис. 8.7. Форма и расположение электронных облаков в молекуле перекиси водорода
К ним подсоединяются обычным способом атомы водорода, причем вследствие отталкивания атомы водорода подсоединяются к кислородным облакам вдоль разных осей, так что линия ОО и две линии НО на рис. 8.7 все взаимно ортогональны (на самом деле валентный угол между ОО и ОН возрастает до ![]() ).
).
В некоторых молекулах связи между атомами осуществляются не одной, а двумя или тремя парами электронов (двойные или тройные связи). Пример тройной связи: молекула ![]() , которую химики записывают в виде
, которую химики записывают в виде
![]()
(черточка соответствует паре электронов). Тройная связь атома углерода имеет место в молекуле ацетилена:
![]()
Двойная связь атома углерода в молекуле этилена:
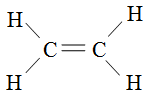
Квантовая механика объясняет эти и более сложные типы связей.



