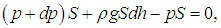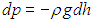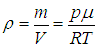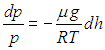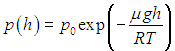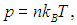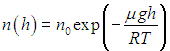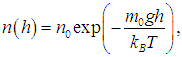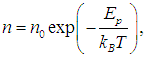3.4. Распределение молекул по координатам
В этом разделе мы перейдем теперь к анализу распределения молекул газа по координатам. Очевидно, что если на молекулы газа не действуют внешние силы, то, в состоянии термодинамического равновесия, газ равномерно распределен по заданному объему. В этом случае давление и плотность газа одинаковы во всех точках. Если же газ находится в силовом поле (как, например, атмосферный воздух, который испытывает притяжение Земли), то давление и плотность газа уже не будут всюду одинаковыми, а будут меняться от точки к точке.
Видео 3.4. Распределение молекул газа по высоте сосуда, находящегося в однородном поле тяжести.
Барометрическая формула. Найдем закон, по которому изменяется давление атмосферы (или плотность воздуха) по мере удаления от поверхности Земли. Выделим вертикальный столб воздуха с площадью горизонтального сечения S.
Предположим, что
-
этот столб находится в тепловом равновесии, то есть температура везде одинакова (в реальной атмосфере это не так, но для простоты анализа будем предполагать Т = const);
-
газ идеальный, то есть для него справедливо уравнение Клапейрона — Менделеева
![]()
-
можно пренебречь изменением ускорения свободного падения g с высотой (что справедливо для не очень больших высот).
Атмосферное давление на высоте h обусловлено весом вышележащих слоев газа. Пусть на высоте h давление р, тогда на высоте h + dh давление р + dp (рис. 3.6). При этом, если dh > 0, то давление уменьшается, dp < 0, так как уменьшается вес вышележащих слоев атмосферы.

Рис. 3.6. Вертикальный воздушный цилиндр (к выводу барометрической формулы)
Выделенный слой газа, высотой dh и массой m, находится в равновесии. Следовательно, сумма действующих на него сил равна нулю:
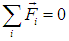
В проекции на вертикальную ось получаем
|
|
|
(3.45) |
где r — плотность газа на высоте h. Раскрывая скобки и приводя подобные члены, переходим к уравнению
|
|
|
(3.46) |
Воспользуемся уравнением Клапейрона — Менделеева для выделенной массы газа m и выразим плотность через давление:
|
|
|
(3.47) |
Подставляя (3.47) в (3.46), окончательно получаем
|
|
|
(3.48) |
Это уравнение можно проинтегрировать в случае изотермической атмосферы (Т = const):
|
|
|
(3.49) |
Постоянная интегрирования р0 равна давлению на поверхности (h = 0). Полученная зависимость называется барометрической формулой. Она описывает распределение давления газа по высоте в однородном поле тяжести при постоянной температуре. Следует обратить внимание на то, что распределение зависит от рода газа. Чем меньше m, тем меньше по абсолютной величине показатель степени, и тем медленнее для такого газа уменьшается давление при увеличении высоты. На рис. 3.7 показаны зависимости давления от высоты при температуре Т = 300 К (27 °С) для трех газов различной молярной массы — водорода Н2 (m1 = 2,016 г/моль), азота N2 (m2 = 28,013 г/моль) и кислорода 02 (m3 = 31,999 г/моль).
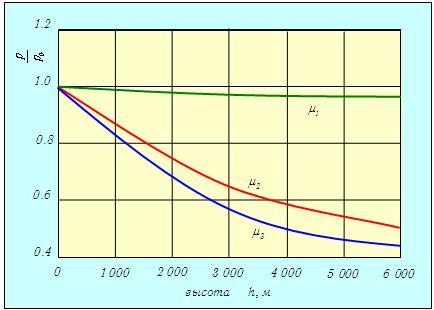
Рис. 3.7. Зависимость давления трех разных газов Н2, N2 и O2 от высоты
Пример. Определим, на какой высоте давление кислорода уменьшается в два раза (при Т = 300 К).
Применяем барометрическую формулу.
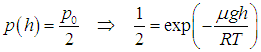
Тогда

откуда
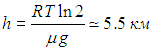
Используя уравнение идеального газа в форме
|
|
|
(3.50) |
из барометрической формулы легко получить закон изменения с высотой числа n молекул в единице объема:
|
|
|
(3.51) |
Из (3.51) следует, что состав воздуха с ростом высоты будет меняться количественно: возрастет концентрация газов с малой молярной массой, например водорода и гелия.
У поверхности воздух представляет собой смесь газов: N2 — 78,08 %, O2 — 20,95 %, СO2 — 0,03 %, инертные газы — 0,94 %. Посмотрим, как изменится отношение концентраций кислорода и азота в изотермической атмосфере (Т = 300 К) на высоте 10 км.
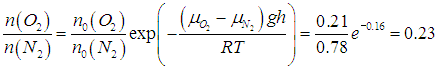
Отношение концентраций кислорода и азота уменьшится от 0,27 до 0,23. Наш расчет справедлив лишь для изотермической атмосферы и сравнительно небольших высот, для которых ускорение свободного падения изменяется незначительно: g = const, T = const.
Распределение Больцмана. Число молекул в единице объема зависит от высоты h и температуры Т, причем обе переменные входят в показатель экспоненты. Уравнение (3.51) можно записать в виде
|
|
|
(3.53) |
где kB — масса одной молекулы газа. При этом выражение m0gh, стоящее в числителе, есть не что иное, как потенциальная энергия одной молекулы в поле тяжести Земли. Поэтому можно говорить, что мы имеем распределение молекул по значениям потенциальной энергии. При этом чем больше потенциальная энергия, тем меньше таких молекул. В знаменателе показателя степени стоит kBТ — величина, пропорциональная средней энергии теплового движения молекулы. Чем выше температура, то есть чем больше энергия теплового движения молекул, тем экспоненциальный множитель, пропорциональный концентрации молекул, с ростом высоты убывает медленнее. На рис. 3.8 показаны кривые относительной концентрации молекул кислорода O2 на разных высотах при двух различных температурах Т1 = 300 К и Т2 = 1 300 К (последний случай, конечно, нереален и используется лишь как иллюстрация).

Рис. 3.8. Зависимость относительной концентрации молекул кислорода от высоты при разных температурах T1 = 300 K и T2 = 1 300 K
Видно, что число частиц в единице объема при большей температуре медленнее убывает с высотой. При уменьшении температуры большая часть частиц располагается на меньшей высоте. А при Т = 0 все частицы расположились бы на поверхности Земли. Этот факт имеет простое физическое объяснение. Каждое конкретное распределение молекул по высоте устанавливается в результате действия двух тенденций:
-
притяжение молекул к Земле, характеризуемое потенциальной энергией m0gh, стремится расположить их на поверхности Земли;
-
тепловое движение, характеризуемое энергией kBТ, стремится разбросать молекулы по всем высотам равномерно.
Обозначив Ер = m0gh, получим
|
|
|
(3.53) |
то есть концентрация молекул больше там, где меньше их потенциальная энергия. Частицы будут с большей вероятностью располагаться в тех точках пространства, где потенциальная энергия меньше.
Больцман доказал, что такое распределение осуществляется в поле любых сил, а не только в гравитационном поле. Поэтому распределение (3.53), где n — концентрация частиц с потенциальной энергией Ер называется распределением Больцмана.