ГЛАВА 20. ВНУТРЕННЯЯ ЭНЕРГИЯ ГАЗА. ПРЕВРАЩЕНИЯ ЭНЕРГИИ В ТЕПЛОВЫХ ПРОЦЕССАХ. ПЕРВЫЙ ЗАКОН ТЕРМОДИНАМИКИ
Поскольку приращение внутренней энергии ![]() U может быть как положительным (если внутренняя энергия растет), так и отрицательным (если внутренняя энергия убывает), то количество переданной газу теплоты удобно считать величиной алгебраической и обобщить формулу (20.3) отдачи газом энергии в процессе теплообмена:
U может быть как положительным (если внутренняя энергия растет), так и отрицательным (если внутренняя энергия убывает), то количество переданной газу теплоты удобно считать величиной алгебраической и обобщить формулу (20.3) отдачи газом энергии в процессе теплообмена:
(20.4)
Существует и другой способ изменения внутренней энергии. Как показывает опыт, если газ расширяется без теплообмена с окружающей средой, его температура, а, следовательно, и внутренняя
энергия уменьшается. Это происходит потому, что молекулы газа будут совершать положительную работу A над движущимися стенками сосуда, в котором находится газ, и, следовательно, отдают часть своей энергии окружающим телам. Если газ сжимается, молекулы газа совершают отрицательную работу над стенками сосуда, то есть будут получать энергию от внешних тел, и внутренняя энергия газа увеличится. Поэтому и для расширения и для сжатия газа справедливо соотношение:
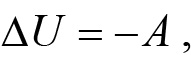 где A — работа, совершенная газом над стенками сосуда. Величина A может быть как положительной, так и отрицательной
где A — работа, совершенная газом над стенками сосуда. Величина A может быть как положительной, так и отрицательной
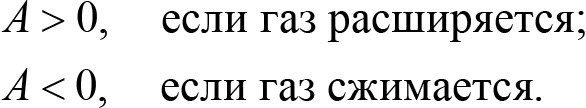 Если одновременно имеют место оба механизма изменения внутренней энергии — и теплообмен, и расширение-сжатие газа, в котором газ совершает механическую работу — то
Если одновременно имеют место оба механизма изменения внутренней энергии — и теплообмен, и расширение-сжатие газа, в котором газ совершает механическую работу — то
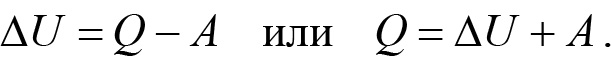 Уравнение (20.7), представляющее математическое выражение закона сохранения энергии для тепловых процессов, называется первым законом (или первым началом) термодинамики.
Уравнение (20.7), представляющее математическое выражение закона сохранения энергии для тепловых процессов, называется первым законом (или первым началом) термодинамики.
(20.5)
(20.6)
(20.7)
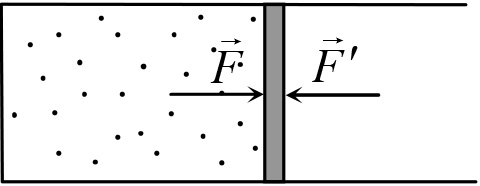
Рис. 20.1
Одновременно с газом при сжатии или расширении совершают работу и внешние силы, действующие на газ. Рассмотрим, например, газ, находящийся в цилиндрическом сосуде и отделенный от атмосферы поршнем (рис. 20.1).


