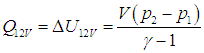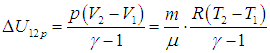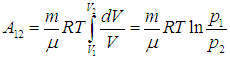2.2. Работа идеального газа в различных процессах
Имея уравнение состояния (1.7 ) идеального газа, мы найдем совершаемую им работу при некоторых типичных процессах. Заодно определим количество теплоты, получаемое от внешнего источника.
) идеального газа, мы найдем совершаемую им работу при некоторых типичных процессах. Заодно определим количество теплоты, получаемое от внешнего источника.
1. Изохорный процесс. При изохорном нагревании или охлаждении (соответственно, прямые 1–2 и 1–3 на рис. 2.7) работа просто равна нулю, поскольку объем не меняется.

Рис. 2.7. определению работы в изохорном процессе
Получаемое количество теплоты (обозначим Q12 при V = const через Q12V) полностью идет на изменение внутренней энергии газа (см. (1.19 ))
))
|
|
|
(2.6) |
Ту же самую величину можно выразить через изменение температуры газа
|
|
|
(2.7) |
2. Изобарный процесс. Поскольку в этом процессе р = const, то давление можно вынести из-под знака интеграла в (2.3 ). Тогда получаем (рис. 2.8)
). Тогда получаем (рис. 2.8)
|
|
|
(2.8) |

Рис. 2.8. Работа в изобарном процессе
Изменение внутренней энергии газа следует из (1.17) – (1.19) 1.17
1.17![]() 1.18
1.18 1.19:
1.19:
|
|
|
(2.9) |
Складывая (2.8) и (2.9), находим количество теплоты, переданное газу в этом процессе:
|
|
|
(2.10) |
Пример 1. Пусть система получила при постоянном давлении определенное количество теплоты Q. Найдем, какая часть расходуется на совершение работы А, а какая — на увеличение внутренней энергии газа. Определим также, как зависит ответ от вида используемого газа.
Из формул (2.8) и (2.9) сразу следует, что

Чем больше g, тем большая часть тепла переходит в работу: для одноатомных газов

для двухатомных (без учета колебаний ядер, при двух вращательных степенях свободы)

и для многоатомных газов (без учета колебаний ядер, при трех вращательных степенях свободы)

Заметим, что мы излагаем достаточно общий подход, который применим не только к идеальным газам. Для иных систем может измениться уравнение состояния, как следствие изменятся выражения для совершенной работы, но принципы их вывода остаются одними и теми же. Приведем пример. Пусть для некоторой системы давление, температура и объем связаны соотношением
|
|
|
(2.11) |
Найдем выражение для работы такой системы при изменении ее температуры от Т1 до Т2 при постоянном давлении. Поскольку давление постоянно, имеем для работы в изобарном процессе стандартное выражение

Используя уравнение состояния (2.11), находим отсюда

3. Изотермический процесс расширения (или сжатия) газа может происходить в условиях, когда теплообмен между газом и внешней средой осуществляется при постоянной разности температур. Для этого теплоемкость внешней среды должна быть достаточно велика, и процесс расширения (или сжатия) должен происходить достаточно медленно. Диаграмма изотермического расширения представлена на рис. 2.9.

Рис. 2.9. Работа при изотермическом расширении системы
Используя уравнение состояния и выражение (2.2 ) для элементарной работы, находим
) для элементарной работы, находим
|
|
|
(2.12) |
Далее используем общее выражение (2.3 ) для работы при конечном изменении объема
) для работы при конечном изменении объема
|
|
|
(2.13) |
Поскольку объем обратно пропорционален давлению, тот же результат можно представить в виде
|
|
|
(2.14) |
Так как внутренняя энергия идеального газа не меняется при изотермическом процессе, в работу преобразовалась вся теплота, полученная от источника:
![]()
Пример 2. Расширяясь, водород совершил работу 6 кДж. Найдем количество теплоты, подведенное к газу, если процесс протекал: а) изобарно; б) изотермически.
Рассмотрим сначала изобарное расширение. Из формул (2.8) и (2.10) следует связь количества теплоты и совершенной работы:

Мы использовали значение g = 7/5 для двухатомного газа. Для изотермического расширения, как мы видели, полученное количество теплоты просто равно произведенной работе:
![]()
Видео 2.1. Работа нагретого газа над вертушкой.
Дополнительная информация
http://kvant.mirror1.mccme.ru/ — Журнал Квант, 2004, № 3, стр. 32–33, А. Леонович «А так ли хорошо знакома вам теплопередача?», — попробуйте ответить на оригинальные вопросы, связанные с теплообменом.