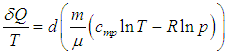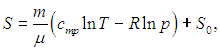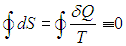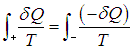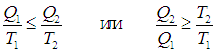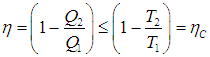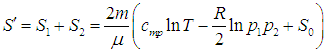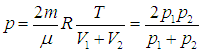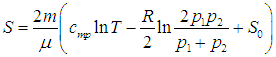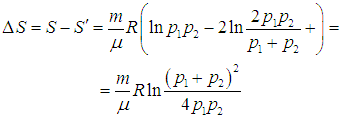5.4. Энтропия
В классической механике и электродинамике мы привыкли к тому, что невозможность какого-то процесса, как правило, связана с каким-то законом сохранения (энергии, импульса, электрического заряда и т. п.). Почему же невозможен вечный двигатель второго рода? Казалось бы, он не нарушает никаких законов сохранения? Чтобы понять это, надо обратиться еще к одной функции состояния системы — к энтропии.
Путь к этой новой для нас функции состояния недолог: надо взять уравнение первого начала термодинамики
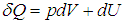
и разделить его обе части на температуру. Прежде всего учтем, что
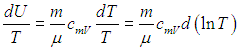
Далее в формуле для элементарной работы
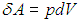
выразим объем через давление и температуру из уравнения состояния (1.7 ) идеального газа:
) идеального газа:
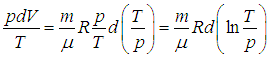
Получим в итоге с использованием соотношения Майера между молярными теплоемкостями
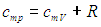
следующее выражение
|
|
|
(5.17) |
Правая часть (5.34) представляет собой дифференциал некоторой функции S состояния системы:
|
|
|
(5.18) |
где S0 — постоянная интегрирования, не зависящая от термодинамических параметров системы (давления, объема, температуры). Эта функция S называется энтропией. Получилось так, что величина dQ, не являющаяся дифференциалом какой-либо функции состояния, при делении на T стала таковым:
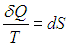
При замкнутом обратимом цикле изменение любой функции состояния (в частности, энтропии) равно нулю:
|
|
|
(5.19) |
Кружок на знаке интеграла означает, что интегрирование ведется по замкнутому контуру.
Проверим выполнение (5.19) на примере цикла Карно. Поскольку в этом цикле тепло получается системой и отдается только на изотермах (Т1,2 = const), температуру можно вынести из-под знака интеграла, и тогда интегрирование даст просто количество теплоты, поделенное на температуру, при которой оно получается или отдается. И действительно, выше было найдено, что на изотермических ветвях цикла при температуре Т1 газ получает теплоту
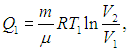
а при температуре Т2 — отдает теплоту
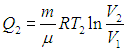
Выполнение равенства
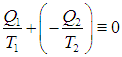
теперь очевидно. Напомним, что получаемое тепло имеет положительный знак, а отдаваемое — отрицательный; мы же определили ранее Q2 как абсолютную величину отдаваемого тепла, поэтому в формуле появился знак «–».
Проделаем теперь похожие выкладки с произвольным обратимым циклом. Выделим в нем две части: знаком «+» обозначим те фазы процесса, когда система получает тепло, а знаком «–» фазы, когда система отдает тепло. Поскольку полный интеграл равен нулю, аналогичные интегралы по двум частям цикла равны между собой:
|
|
|
(5.20) |
Если обозначить через Т1 максимальную температуру в первой части цикла, то неравенство Т < Т1 влечет за собой неравенство
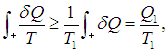
где Q1 как и прежде означает полное количество теплоты, полученное системой. Если ввести минимальную температуру Т2 во второй части цикла, то из Т > Т2 следует
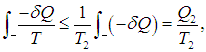
где Q2 — количество теплоты, отданное системой. Из этих неравенств и соотношения (5.20) следует, что
|
|
|
(5.21) |
Наконец получаем неравенство для КПД цикла
|
|
|
(5.22) |
С помощью понятия энтропии мы получили иным путем тот же результат: КПД любого цикла не превышает КПД цикла Карно с температурой нагревателя равной максимальной температуре рабочего тела и с температурой холодильника равной минимальной температуре рабочего тела рассматриваемого цикла. В дальнейшем мы будем опускать указание на то, что сравниваются КПД тепловых машин, работающих в одном и том же интервале температур.
Таким образом, мы убедились, что новая функция состояния — энтропия — связана со вторым началом термодинамики. До сих пор мы ограничивались равновесными (обратимыми) процессами. Рассмотрим пример неравновесного процесса. Пусть в начальном состоянии имеются два одинаковых идеальных газа с равными массами m при одинаковой температуре Т, но разных давлениях р1 и р2. Определим изменение энтропии ![]() при соединении сосудов с газом.
при соединении сосудов с газом.
В первый момент после соединения сосудов, когда газы еще не смешались, энтропия системы равна сумме энтропии газов в отдельных сосудах:
|
|
|
(5.23) |
Найдем теперь объемы сосудов:
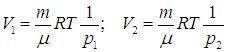
После соединения сосудов масса газа становится равной 2m, а объем — V = V1 + V2. Значит, давление р после соединения сосудов равно
|
|
|
(5.24) |
Поэтому энтропия газа после соединения сосудов равна
|
|
|
(5.25) |
Приращение энтропии ![]() находится из (5.23) и (5.25):
находится из (5.23) и (5.25):
|
|
|
(5.26) |
Под знаком логарифма стоит величина, всегда большая единицы. Стало быть, энтропия увеличилась: ![]() > 0.
> 0.
Цель этого примера, прежде всего, состоит в том, чтобы на частном случае продемонстрировать, как работает закон возрастания энтропии:
|
Если замкнутая система в некоторый момент времени находится в неравновесном состоянии, то процессы, протекающие в ней, приводят к возрастанию энтропии, которая достигает максимума, когда система приходит в равновесие. |
После того как мы соединили сосуды и, тем самым, открыли возможность перемешивания газов, мы получили неравновесное состояние с энтропией, равной сумме энтропий, газы стали перемешиваться, давления выравниваться, система перешла в равновесное состояние с большей, чем ранее энтропией. В результате перехода (благодаря внутренним процессам в системе) из первоначально неравновесного состояния в конечное равновесное состояние энтропия системы возрастает.
Дополнительная информация
http://www.femto.com.ua/articles/part_2/4761.html — Физическая энциклопедия. Энтропия.