ГЛАВА 18. ГАЗОВЫЕ ЗАКОНЫ
где m/2 и m/4 — массы кислорода и неизвестного газа в баллоне; ![]() — молярная масса неизвестного газа;
— молярная масса неизвестного газа; ![]() =
= ![]() + 273° — абсолютная температура смеси газов в момент разрыва баллона. Приравнивая правые части этих уравнений и сокращая неизвестные V и m, а также универсальную газовую постоянную R, получаем уравнение относительно неизвестной молярной массы
+ 273° — абсолютная температура смеси газов в момент разрыва баллона. Приравнивая правые части этих уравнений и сокращая неизвестные V и m, а также универсальную газовую постоянную R, получаем уравнение относительно неизвестной молярной массы ![]() :
:
![]()
Решая это уравнение, находим
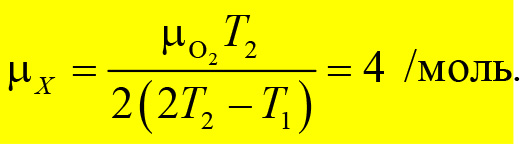
Таким образом, неизвестный газ — гелий.
Задачи для самостоятельного решения
1. В сосуде неизменного объема содержится идеальный газ в количестве 2 моль. Как надо изменить абсолютную температуру газа в сосуде, чтобы при добавлении в сосуд еще одного моля газа давление в сосуде увеличилось в 3 раза?
А. Уменьшить в 2 раза. Б. Увеличить в 2 раза.
В. Уменьшить в 3 раза. Г. Увеличить в 3 раза.
2. В сосуде объемом 8,31 л находится идеальный газ при температуре 127 °С под давлением 100 кПа. Какое количество вещества газа содержится в сосуде?
А. 0,25 моль. Б. 0,5 моль. В. 0,75 моль. Г. 1 моль.
3. Имеется смесь гелия и озона в количестве 1 и 2 молей соответственно. С течением времени озон превратился в молекулярный кислород. Изменится ли давление в сосуде, и если да, то во сколько раз? Температура смеси не изменялась.
А. Не изменится. Б. Увеличится в 4/3 раза.
В. Увеличится в 5/3 раза. Г. Увеличится в 3/2 раза.
4. Два баллона с кислородом объемом ![]() = 2 л и
= 2 л и ![]() = 7 л соединили трубкой. Какое давление установится в баллонах, если до соединения оно соответственно было равно
= 7 л соединили трубкой. Какое давление установится в баллонах, если до соединения оно соответственно было равно ![]() = 1·105 Па и
= 1·105 Па и ![]() = 0,52·105 Па? Температура газа не изменилась. Газ считать идеальным.
= 0,52·105 Па? Температура газа не изменилась. Газ считать идеальным.


