ГЛАВА 36. АТОМНАЯ И ЯДЕРНАЯ ФИЗИКА
В рамках теории Бора можно объяснить спектры излучения атомов и вычислить постоянную Ридберга. Рассмотрим два примера.
Пример 36.2. В модели Бора рассчитать радиус разрешенной орбиты с главным квантовым числом n в атоме водорода и скорость электрона на этой орбите.
Решение. В модели Бора, радиус rn разрешенной электронной орбиты и скорость νn электрона на ней связаны условием квантования (36.3)
![]()
Для определения двух неизвестных величин rn и νn необходимо еще одно уравнение. Согласно предположению Бора, электрон вращается вокруг ядра по круговой орбите. При этом сила взаимодействия между электроном и ядром определяет центростремительное ускорение электрона на этой орбите. На основании второго закона Ньютона для электрона на n-й орбите имеем:
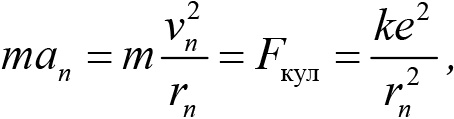
где e и m — заряд и масса электрона; k — постоянная закона Кулона. Совместное решение первого и второго уравнений дает
Из формулы (36.4) следует, что радиусы орбит растут квадратично с ростом номера орбиты: rn = n2a, где a — радиус первой стационарной орбиты, которой отвечает квантовое число n = 1 и который называется боровским радиусом атома водорода
Подставляя в формулу (36.5) известные значения: h = 6,62·10−34 Дж·с, k = 9·109 м/Ф, m = 9,11·10−31 кг, e = 1,6·10−19 Кл, получаем для боровского радиуса


